Alternativer SARS-CoV-2 Infektionsweg über Hirngefäße identifiziert
Neurologische Komplikationen in Zusammenhang mit COVID-19 sind vielfach beobachtet worden. Obwohl das SARS-CoV-2-Virus im Hirngewebe von Patientinnen und Patienten bereits nachgewiesen wurde, sind dessen Eintrittswege und die daraus resultierenden Folgen nicht gut verstanden. Ein Forscherteam des Fraunhofer-Instituts für Translationale Medizin und Pharmakologie ITMP und des Universitätsklinikums Hamburg-Eppendorf (UKE) hat nun gezeigt, dass Zellen der Blut-Hirn-Schranke (BHS) in-vitro durch den SARS-CoV-2-Erreger infiziert werden können. Die BHS ist eine wichtige Schnittstelle zwischen dem peripheren Gefäßsystem und dem Zentralnervensystem. Zudem wurde ein Testsystem basierend auf humanen pluripotenten Stammzellen entwickelt, mit dem Therapeutika auf ihre Wirkung hin überprüft werden können, um diese Infektion abzuschwächen. Die Studienergebnisse wurden heute im Journal Stem Cell Reports veröffentlicht.
Hamburg. Bereits seit Februar 2020 entwickeln Wissenschaftlerinnen und Wissenschaftler der Fraunhofer-Gesellschaft präklinische Modelle und mit deren Hilfe Wirkstoffkandidaten zur Behandlung von COVID-19. »Das Aktionsprogramm »Fraunhofer vs. Corona« hat uns in die Lage versetzt, unsere Ressourcen und Expertise auf die Pandemie zu fokussieren und in die Anwendung zu bringen«, sagt Dr. Ole Pless, Wissenschaftler am Fraunhofer ITMP und zugleich Laborleiter einer Gastgruppe am Zentrum für Molekulare Neurobiologie Hamburg (ZMNH) des UKE. »Zudem haben wir in einem vom Bundesministerium für Bildung und Forschung geförderten Projekt die notwendigen Zellmodelle entwickelt, die wir in der Pandemie direkt zur Anwendung bringen konnten.«
»Aufgrund unseres umfangreichen Wissens über die Pathologie von COVID-19, einschließlich der Pathologie des Zentralnervensystems, konnten wir präzise molekulare Veränderungen an der Blut-Hirn-Schranke beschreiben. Diese wurden in den Fraunhofer-Zellmodellen bestätigt«, sagt die Erstautorin der Studie, Priv.-Doz. Dr. Susanne Krasemann vom Institut für Neuropathologie des UKE. Die Studie wurde unter Beteiligung von mehreren Instituten des UKE und weiteren internationalen Partnern durchgeführt.
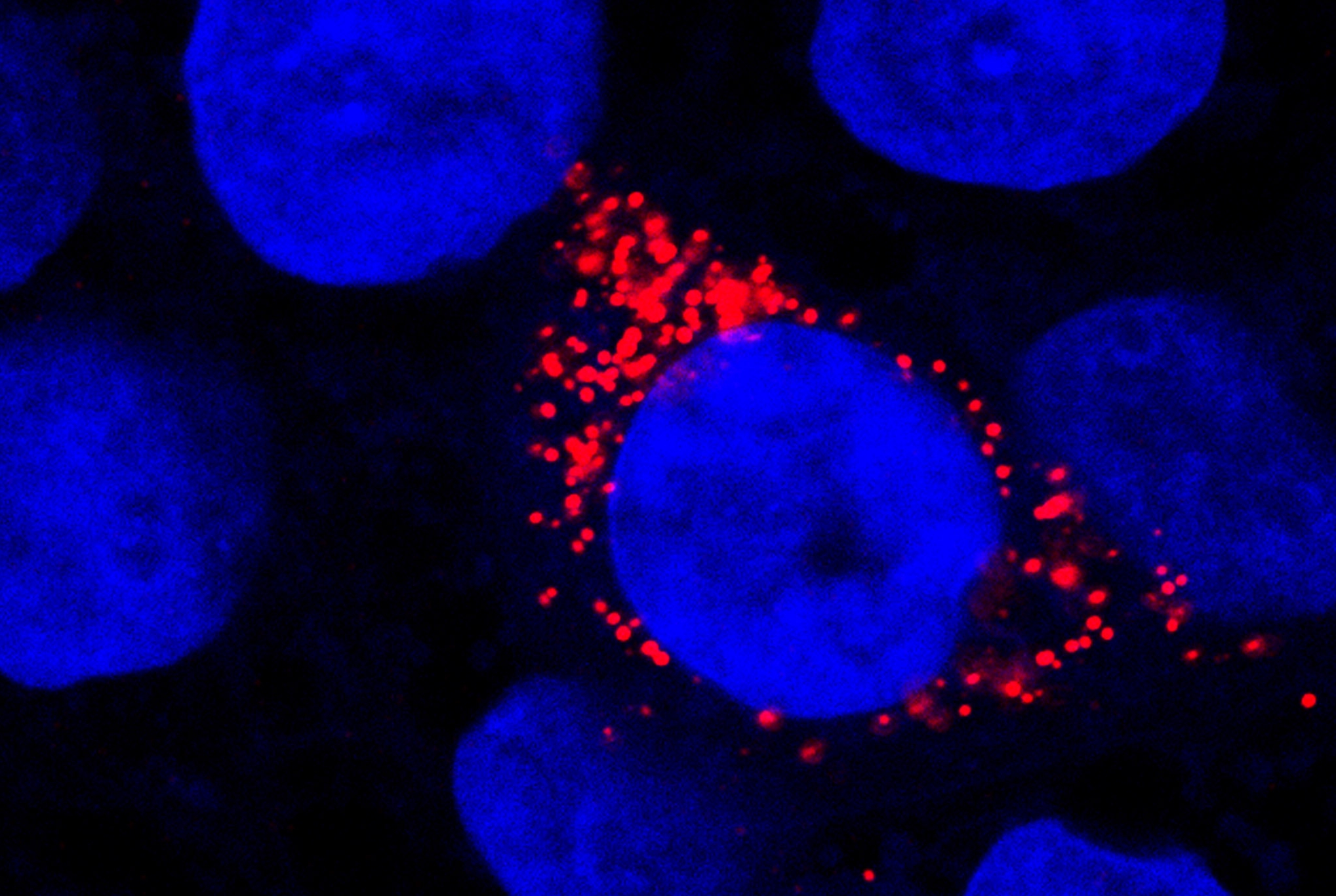
COVID-19: Eigenschaften der Hirnpathologie lassen sich in der Zellkultur nachbilden
Über die umfangreiche Analyse von post-mortem-Hirngewebe von COVID-19-Patientinnen und Patienten konnte eine Hochregulation von Interferon-Gamma-Signalwegen, einem Kennzeichen der Virusabwehr, in der neurovaskulären Einheit der BHS nachgewiesen werden. Durch die Nutzung pluripotenter Stammzellen gelang es den Autorinnen und Autoren der Studie, diese Anfälligkeit von Endothelzellen der Hirnkapillaren für eine SARS-CoV-2-Infektion im Labor nachzustellen. In einem in-vitro Testsystem konnten sie die Vervielfältigung des Virus in den Zellen und dessen Transport über die BHS beobachten. Dieses Modell wurde in der Folge für die Prüfung von Substanzen angewandt, die das Eindringen des Virus über die BHS verhindern, wie zum Beispiel spezifische Proteaseinhibitoren. Es wurde also eine Plattform für die Testung von Medikamenten geschaffen, die das Eindringen von SARS-CoV-2 in das Zentralnervensystem verhindern und die daraus resultierenden neurologischen Folgen abschwächen könnten.
Zentrale gesellschaftliche Herausforderung
»Eine große Anzahl an Wissenschaftlerinnen und Wissenschaftlern aus verschiedenen Fachbereichen des UKE forscht seit Beginn der Pandemie zum SARS-CoV-2-Erreger. Wir begleiten dabei die verschiedenen Dimensionen der für die Pandemie relevanten Forschung koordiniert und legen großen Wert auf Kooperationen mit anderen Forschungseinrichtungen wie dem Fraunhofer ITMP. Die Vernetzung von klinischer und Grundlagenforschung liegt uns dabei besonders am Herzen«, sagt Prof. Dr. Blanche Schwappach-Pignataro, Dekanin der Medizinischen Fakultät und Vorstandsmitglied des UKE.
»Unser Anspruch im neuen Fraunhofer-Institut ITMP ist die Übersetzung der vielversprechendsten Ideen aus der biomedizinischen Grundlagenforschung in die Anwendung zum Wohle der Patientinnen und Patienten und der Gesellschaft. Gerade die enge Verbindung zwischen angewandter Forschung und klinischem Alltag, wie er an unseren Standorten in Frankfurt, Göttingen, Penzberg/München, Berlin und mit dem UKE in Hamburg gelebt wird, ist der Schlüssel für neue Therapien«, sagt Prof. Dr. Dr. Gerd Geißlinger, Institutsleiter des Fraunhofer ITMP.
Publikation
Krasemann et al., The blood-brain barrier is dysregulated in COVID-19 and serves as a CNS entry route for SARS-CoV-2. Stem Cell Reports, 2022.
DOI: https://doi.org/10.1016/j.stemcr.2021.12.011
 Fraunhofer-Institut für Translationale Medizin und Pharmakologie ITMP
Fraunhofer-Institut für Translationale Medizin und Pharmakologie ITMP